Molekylære præcisionsbomber: Har vi råd til fremtidens kemoterapi?

Mads Bang
JournalistAf Thomas B. Poulsen
Adjunk og gruppeleder, Kemisk Institut ved Aarhus Universitet
Har vi råd til at betale for fremtidens kemoterapi, som måske kan gøre kræftsygdomme til kroniske lidelser? Det virker som et skørt spørgsmål i et af verdens rigeste lande, men det presser sig ikke desto mindre på. Et støt stigende antal kræftpatienter i den ældre del af befolkningen kombineret med nye personaliserede behandlingsforløb med ultra-specifikke medikamenter vil med stor sandsynlighed få omkostningerne til at stige drastisk i de kommende år. Artiklen vil dels diskutere de sundhedsøkonomiske aspekter samt give læseren et indblik i den biologiske baggrund for de store paradigmer i den medicinske kræftbehandling - og forsøge at udpege, hvor vi kan forvente de nye gennembrud.
De første succesfulde forsøg på at behandle en kræftsygdom med medicin blev foretaget i tiden lige omkring 2. Verdenskrig. Særligt væsentlige skulle vise sig at være en række eksperimenter udført på Boston Childrens Hospital i 1948 af en amerikansk patolog ved navn Sidney Farber, hvis patienter var børn med uhelbredelig leukæmi. Selvom de første eksperimentelle behandlinger bestemt ikke var voldsomt effektive - faktisk så døde næsten alle patienterne efter en relativ kortvarig forbedring i deres tilstand - så var det første gang, man observerede en egentlig opbremsning af kræftsygdom hos patienter, og dermed etableredes et helt nyt paradigme i kræftbehandlingen: Kemoterapi.
Ordet kemoterapi er faktisk en smule misvisende, idet alle andre typer medicinske behandlinger, fra brug af antibiotika til kolesterol-sænkende behandlinger, ligeledes er "terapi ved brug af kemikalier". Det til trods, så anvendes ordet udelukkende om medicinsk behandling af kræftsygdomme. Det er derfor vigtigt at understrege, at der således ikke er noget fundamentalt kemisk eller fysisk anderledes ved den type af molekyler, som udgør "kemoterapi", relativt til medicin, som anvendes til behandling af andre sygdomme.
Der ér dog forskel, og den forskel ligger helt grundlæggende i den måde, som molekylerne virker på biologisk med hensyn til de cellulære processer, som de påvirker. Jeg vil komme nærmere ind på dette i slutningen af artiklen, men meget firkantet set, så skal virkningsfuld kemoterapi være i stand til at dræbe nogle typer af celler fra vores egen krop (altså kræftcellerne) uden at gøre alvorlig skade på alle de andre celler. Måske ikke overraskende, så er det udfordrende at finde et såkaldt terapeutisk vindue, hvor en effektiv behandling er mulig uden uacceptable bivirkninger, som skyldes at medicinen også påvirker kroppens raske celler.
Altinget | Forskningsformidling giver forskerne mulighed for at skrive direkte til de fagmiljøer, som kan have glæde af deres forskning.
Artiklerne er skrevet af forskerne selv og bygger på ny forskning, bøger eller videnskabelige artikler.
Altinget | Forskningsformidling udsender et gratis nyhedsbrev hver 14. dag, hvor du kan se de seneste formidlingsartikler. Desuden udsender Altinget.dk artiklerne til de relevante fagportaler.
Nyhedsbrevet rummer forskning fra en lang rækkes samfundsvidenskabelige specialer.
Du kan tilmelde dig nyhedsbrevet her.
Hvis du er forsker og gerne vil skrive en formidlingsartikel om din forskning, så skriv til [email protected].
Om forfatteren
Thomas B. Poulsen er adjunkt og gruppeleder på Kemisk institut, Aarhus Universtet.
Han er desuden medlem af Det Unge Akademi under Det Kongelige Danske Videnskabernes Selskab. Thomas B. Poulsen har en PhD-grad fra Aarhus Universitet i 2008 og har efterfølgende været forsker på Harvard University i USA.
Siden 2012 har han haft sin egen forskergruppe på Aarhus Universitet, hvor hans forskning blandt andet sigter mod at opdage nye molekyler, som kan øge vores viden om kræftstamceller og deres involvering i metastase.
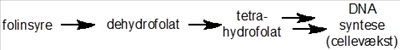
Udfordringerne til trods, så udgør kemoterapi en ganske betydelig del af de behandlinger, som anvendes til behandling af kræftsygdomme; de andre store behandlingsmodaliteter er operative indgreb og stråleterapi.
Antallet af kemobehandlinger
Et støt stigende antal kræftpatienter i den ældre del af befolkningen kombineret med nye personaliserede behandlingsforløb med ultra-specifikke medikamenter vil med stor sandsynlighed få omkostningerne til at stige drastisk i de kommende år.
Thomas B. Poulsen
Adjunkt, gruppeleder, Aarhus Universitet
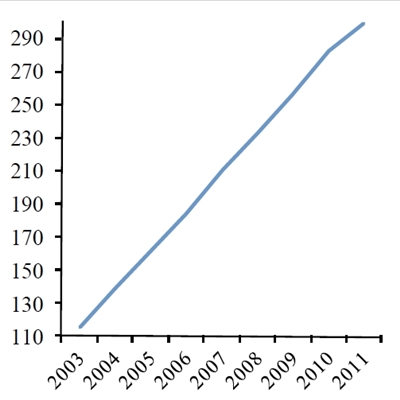
<img align="center" src="@nyimg=16624@"/>
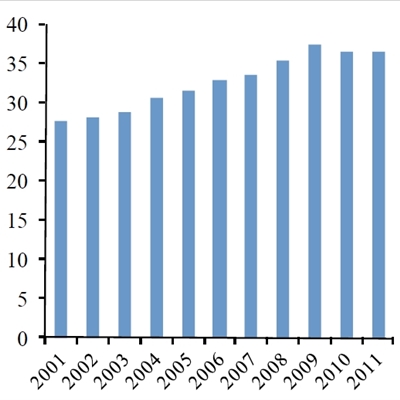
Udvikling i antallet (x1000) af årlige kemoterapibehandlinger i Danmark i perioden 2004-11. Kilde: Nøgletal for Kræft, januar 2013, Ministeriet for sundhed og forebyggelse.
Årlige nye kræfttilfælde
<img align="center" src="@nyimg=16627@"/>
Antallet (x1000) af årlige nye kræfttilfælde i Danmark 2001-11. Kilde: Nøgletal for Kræft, januar 2013, Ministeriet for sundhed og forebyggelse.
I de seneste ca. 10 år er brugen af kemoterapi til kræftbehandling øget markant i hele den vestlige verden, f.eks. viser relativt nylige tal, at vi i Danmark er gået fra ca. 110.000 årlige behandlinger i 2004 til næsten 300.000 behandlinger i 2011 (Figur 1a). Der har været en tilsvarende stor stigning i antallet af kræftoperationer samt strålebehandlinger i den samme periode. Kun en lille del af denne kraftige forøgelse kan tilskrives en stigning (ca. 30%) i antallet af nye kræfttilfælde (Figur 1b). Den primære forklaring på stigningen må derfor tilskrives forbedringer i hospitalernes effektivitet samt en forøget mulighed for at foretage behandling i situationer, hvor man ikke tidligere har kunnet gøre noget for patienterne.
Det er jo ved første øjekast udelukkende en god ting, men idet behandling af kræftsygdomme desværre i langt de fleste tilfælde ikke leder til en kur, så er der faktisk også en række udfordringer, særligt økonomiske, forbundet med den stigende mulighed for at behandle (men altså ikke kurere) kræftsygdomme. I den forbindelse er kemoterapien den største ubekendte faktor, idet behandlingerne kan variere meget i omfang og - særligt - i omkostning. Udgifterne til kemoterapi er nemlig ikke blot fulgt med det stigende antal behandlinger, de er eskaleret dramatisk, en trend som kan observeres i hele den vestlige verden. Således udgør udgifter til medicin ca. 40% af de samlede udgifter i forbindelse med kræftbehandling i USA (2010). En årlig udgift på svimlende 103 milliarder dollars, hvilket svarer omtrent til 1/3 af Danmarks bruttonationalprodukt. Der er nok ingen tvivl om, at dette tal vil fortsætte med at vokse.
Formålet med denne artikel er først og fremmest at give læseren et indblik i den type kemoterapi, som anvendes i dag, samt at udlægge, hvordan fremtidens behandlinger kan komme til at se ud baseret på de nyeste forskningsresultater. Jeg vil gennemgå de behandlingsparadigmer, man arbejder med inden for kemoterapi, fra dens etablering for ca. 65 år siden til de seneste kliniske forsøg med de allernyeste stoffer. Dette kan ikke gøres uden nødvendigvis at inddrage forskellige termer af udpræget videnskabelig karakter, som sikkert vil udfordre nogle læsere. Jeg mener dog, at der er brugbar viden indlejret i at forstå, hvorfor medicinsk behandling af kræftsygdomme er så vanskelig, idet det desværre er noget næsten alle vil stifte bekendtskab med, direkte eller indirekte. Oversigten er langt fra udtømmende, men burde give en fornemmelse af det store billede. I slutningen af teksten har jeg tilføjet en grundigere gennemgang af, hvordan de forskellige behandlingsformer virker.
Et andet formål med artiklen er at pointere og diskutere de økonomiske konsekvenser, som følger de forøgede muligheder for at behandle kræftsygdomme medicinsk, specielt når man fremskriver, hvordan disse muligheder vil udvikle sig i de kommende år med introduktion af stadig nye behandlinger.
Cytotoksisk kemoterapi
I slutningen af artiklen findes deltaljeret information om to stoffer, methotrexate og paclitaxel, som begge er klassiske eksempler på såkaldt cytotoksisk kemoterapi. Methotrexate er nært beslægtet med det stof som Sidney Farber opdagede i 1948. Der findes massevis af andre forskellige stoffer, som er godkendt til kræftbehandling, og som ligeledes tilhører denne overordnede klasse af kemoterapi. Hvad begrebet cytotoksisk kemoterapi i virkeligheden dækker over, er, at stofferne virker ved at ramme processer, som findes i alle celler, i kræftcellerne såvel som i kroppens almindelige celler. Som nævnt nedenfor interfererer både methotrexate og paclitaxel med de processer, der indgår i celledeling, og dermed er stofferne relativt mere giftige over for celler, som netop deler sig hurtigt. Dette inkluderer kræftcellerne, men også f.eks. blod/immunceller og hårceller. Med det i mente, så er det relativt let at forstå nogle af de almindelige bivirkninger ved cytotoksisk kemoterapi, nemlig nedsat immunfunktion samt hårtab.
I praksis anvendes cytotoksisk kemoterapi i formuleringer, hvor flere forskellige stoffer bruges i kombination. Fordelen ved at kombinere flere stoffer er, at man så at sige angriber flere forskellige punkter samtidigt og dermed opnår en mere effektiv behandling. Man kan dog ikke bare kombinere forskellige stoffer efter forgodtbefindende, idet man ikke let kan forudsige, hvordan en kombination vil opføre sig ud fra de isolerede stoffers effektivitet. Desuden øges bivirkningerne ofte, når flere stoffer kombineres. Enhver kombination skal gennemgå omfattende kliniske tests for at blive godkendt til behandling.
På dette stadie er det relevant at stille et meget simpelt spørgsmål: Hvis ét stof eller en kombination af stoffer rent faktisk er i stand til at slå kræftceller ihjel med acceptable sideeffekter, hvorfor kan vi så ikke kurere sygdommen? Svaret herpå er, at kræftcellerne typisk udvikler resistens over for de stoffer, som de udsættes for. En tilbundsgående forklaring på resistensfænomener i kræftsygdomme vil være for meget at gabe over for denne artikel, men de kan allesammen spores tilbage til, at kræftceller deler sig meget hurtigt, samtidig med at de er genetisk ustabile. Selvom alle kræftceller i en tumor som udgangspunkt stammer fra blot én celle, så har man for ganske nylig observeret en skræmmende grad af heterogenisitet (forskellighed) i biopsier af forskellige dele af den samme tumor. Dette betyder, at der således ikke blot er én slags kræftcelle, som man skal ramme med kemoterapien, men måske hundreder eller tusinder forskellige slags celler. I det øjeblik man udsætter en tumor for giftige stoffer, så pålægger man samtidig et kraftigt evolutionært pres på kræftcellerne for at omgå effekten af disse stoffer. Et scenarie kan således være, at der allerede findes en population af kræftceller, som bærer genetiske ændringer, som gør dem resistente over for en given kemoterapi, og når hele populationen af kræftceller så udsættes for denne, så vil den resistente population kunne ekspandere.
Kræftcellers "opfindsomhed", mht. hvordan de kan omgå effekten af kemoterapi, er desværre skræmmende stor, og flere mekanismer kan være i spil på samme tid. I tilfældet methotrexate, så er det kendt, at kræftceller i mange tilfælde kraftigt øger deres mængde af de enzymer, som methotrexate blokerer, hvilket gør, at selv ved de maksimalt tålbare doser af stoffet, er det ikke muligt at opnå en fuld blokering af enzymet. Ved behandling med paclitaxel, så sker det ofte, at kræftceller begynder at installere pumpe-molekyler på deres overflade, som simpelthen pumper paclitaxel ud af cellen igen.
Målrettet kemoterapi
I løbet 1990'erne skete der noget transformerende inden for den medicinske kræftbehandling. Den forøgede viden omkring de mange genetiske ændringer, som forårsager kræftsygdomme, begyndte at materialisere sig i behandlingsformer, som i princippet burde være helt specifikt rettet mod kræftcellerne.
Baseret på eksperimenter, som blev udført allerede i 1960'erne, lykkedes det i 1990'erne forskere at udvikle et molekyle, imatinib (salgsnavn Gleevec), som hæmmer et protein, der simpelthen kun findes i en særlig type leukæmi som kaldes CML. Du kan finde mere detaljeret information om dette særlige protein og Gleevec i slutningen af artiklen. Introduktionen af Gleevec har ganske simpelt revolutioneret mulighederne for at behandle leukæmi-typen CML. I perioden før Gleevec, så overlevede kun ca 20% af CML-patienter i 5 år eller længere efter deres diagnose. Efter introduktionen af Gleevec, så ligger denne overlevelse i nærheden af 90%. Stoffet blev først introduceret på markedet lige omkring årtusindeskiftet, og derfor foreligger ikke komplette data omkring den endelige overlevelse af patienterne. Gleevec kan sørge for at leukæmien holdes på et meget lavt kronisk stadie, men hvis patienterne ikke længere tager medicinen, så kommer sygdommen tilbage. Vi kommer tilbage til en mulig årsag til dette senere.
Der er altså her tale om et helt unikt medicinsk produkt, der har forvandlet en terminal sygdom til en kronisk sygdom, vel og mærke hvis patienterne fortsætter med at være på medicinen. Med en unik produktprofil, så følger også en unik pris, og det må man sige er tilfældet med Gleevec. I USA ligger omkostningerne for en behandling årligt på et niveau, der svarer til ca. 500.000 DKK, og de årlige globale salgsindtægter for medicinalfirmaet Novartis kun på dette produkt beløber sig til >4 milliarder DKK. Dette eksempel giver ophav til en række svære problemstillinger, som jeg vil introducere nu og forfølge yderligere i slutningen af artiklen.
Grundlæggende handler det om, hvor stor en omkostning må/kan være til en behandling, som åbenlyst er afgørende for en patients overlevelse. Kan vi forvente, at medicinalindustrien vil forsøge at presse prisen op til det maksimale niveau, som markedet kan bære? Måske vil man mene, at dette ene eksempel er stor ståhej for ingenting, og det er da heller ikke behandling af CML-patienter med Gleevec, der truer med at vælte hele systemet. Dels fordi patientgruppen er relativt lille, og dels fordi stoffet mister sin patentbeskyttelse tidligt i 2015, og derfor med rimelig stor sandsynlighed vil blive erstattet af generiske produkter med et dramatisk fald i pris til følge.
Som du kan læse om i slutningen af artiklen, så har man kendt til de unikke genetiske ændringer, der ligger til grund for CML siden 1960'erne, men forskernes evne til at kortlægge sådanne ændringer er simpelthen forøget så radikalt, at vi nu befinder os på et helt nyt niveau. Efter den første sekventering af hele arvematerialet (genom) fra et menneske omkring år 2000, så er teknologien modnet i en sådan grad, at man nu kan kortlægge et helt genom for et beløb i omegnen af nogle tusinde kroner, og denne mulighed har transformeret udviklingen af nye typer af kemoterapi. Gleevec har således blot været en frontløber i et helt nyt paradigme, nemlig den såkaldte målrettede kemoterapi, hvor behandlingen er baseret på at ramme kræftspecifikke proteiner.
Tilkomsten af målrettede behandlinger på kemoterapi-markedet, hvoraf Gleevec nu altså blot er én af en længere række stoffer, falder desuden sammen med en tendens til kraftige prisstigninger. Interessant nok så gælder dette ikke kun det for den nye målrettede kemoterapi, men også for nye stoffer, som i virkeligheden tilhører den cytotoksiske kemoterapi (for sådanne bliver til stadighed udviklet). Desuden synes der at være en temmelig lille sammenhæng mellem et produkts pris og dets effektivitet, og der er ikke mange af de nyeste behandlinger, ja der er faktisk ingen, der har samme effektivitet som Gleevec. Træerne vokser desværre ikke ind i himlen.
Fremtiden
Inden en samlende diskussion, så er det nu tid til at tage et kig på, hvad vi kan forvente af nybrud på kemoterapiområdet i de kommende år. Det vil sikkert være en god nyhed for mange, at der faktisk er rigtig mange nye og innovative behandlingsstrategier under udvikling i øjeblikket. Jeg vil specielt fokusere på to, nemlig behandlinger målrettet mod kræftstamceller samt immunterapi.
En øget forståelse inden for de sidste 5-10 år af den fundamentale biologi af kræftsygdomme har vist, at tumorer har en meget kompleks sammensætning. Kræftceller vokser i et virvar af interaktioner med raske støtteceller og immunceller. En særlig vigtig indsigt har været opdagelsen af, at der tilsyneladende eksisterer populationer af kræftceller, som man kan betegne som stamcelle-lignende. Implikationerne heraf er mange. Som navnet antyder er stamceller en type af celler, som kan give ophav til de andre celler i f.eks. et organ, og i forbindelse med kræftsygdomme betyder dette, at kun en begrænset mængde af cellerne kan understøtte den fortsætte vækst af en tumor samt - helt afgørende - være i stand til at forårsage nye tumorer andre steder i kroppen, som en del af den spredningsproces (metastase), som kendetegner fremskredne kræftsygdomme. Faktisk, så skyldes ca. 90% af alle kræftrelaterede dødsfald netop, at sygdommen spreder sig fra den oprindelige tumor.
Denne indsigt kan have en række behandlingsmæssige implikationer. Idet disse såkaldte kræftstamceller har en relativt langsom cellecyklus, vil de ikke være specielt følsomme over for f.eks. cytotoksisk kemoterapi, der jo primært rammer celler, der deler sig hurtigt. Desuden virker det til, at kræftstamceller har en række yderligere beskyttelsesmekanismer, som tilsyneladende gør dem relativt mindre følsomme over for behandling.
Dette gælder som sagt kemoterapi, men f.eks. også stråleterapi. Faktisk så har man en rigtig god evidens for, at grunden til at man ikke kan kurere CML med stoffet Gleevec netop skyldes en population af kræftstamceller, som ikke responderer på stoffet. I tilfældet CML, så er mutationshastigheden i kræftcellerne meget lav, hvilket betyder, at det i gennemsnit tager lang tid for, at egentlig resistens kan opstå. Selv hvis det opstår, så har man faktisk nyere stoffer, som strukturelt minder om Gleevec, der kan standse (men ikke kurere) kræftsygdommen igen. Denne egenskab for CML er med et rammende udtryk blevet betegnet som "a stupid cancer" af Prof. George Sledge, som er tidligere chef i det amerikanske selskab for klinisk onkologi (ASCO). Der er dog desværre langt flere "smart cancers".
Tilstedeværelsen af kræftstamceller og deres umiddelbare resistens over for traditionelle behandlinger har fået forskere til at stille spørgsmålet, om det ikke burde være muligt at søge efter nye molekyler, som er giftige for både kræftstamcellerne og de "almindelige" kræftceller, eller i alt fald selektivt giftige for kræftstamcellerne. Inden for de sidste 5 år har man faktisk identificeret molekyler, der har sådanne egenskaber, og det er afgørende, at man opnår en molekylær forståelse af, hvordan sådanne molekyler virker, idet det vil kunne give forskerne indsigt i de cellulære processer, som tilsyneladende er kritiske for at understøtte levedygtigheden af kræftstamcellerne.
Der er en række nyligt startede medicinalvirksomheder, særligt i USA, der har programmer, som er fokuseret på at bringe molekyler, som hæmmer kræftstamceller, til kliniske tests; formodentlig i kombination med traditionel kemoterapi. Forhåbningen er selvfølgelig, at hvis man både kan eliminere kræftstamcellerne og de "almindelige" kræftceller, så vil man simpelthen kunne kurere sygdommen. Lignende forhåbninger har man haft mange gange i kemoterapiens historie og næsten altid uden held, men behandlingsparadigmet er nyt, så der er da afgjort grund til at fastholde en vis optimisme. Inden for dette område er det værd at holde øje med virksomheder såsom Verastem, Boston Biomedical og OncoMed Pharmaceuticals. Desuden har nogle af de store medicinalfirmaer, såsom Pfizer, aktive programmer. De første store kliniske tests er nok stadig et par år ude i fremtiden og dermed også indikationerne på potentialet i denne type behandling.
En helt anderledes tilgang til kræftbehandling går ud på at udnytte kroppens eget immunforsvar til at eliminere kræftcellerne. Formodentlig foregår dette konstant i os allesammen, idet forstadierne til egentlige kræftsygdomme i form af ændrede celler kan genkendes og elimineres af immunceller. Det er dog kendt, at kræftceller udvikler mekanismer, der kan virke immundæmpende, og dermed kan de undgå genkendelse og elimination.
Der er dog en række nye undersøgelser, der indikerer, at immunceller kan boostes, enten ved at bruge nye stoffer, der blokerer kræftcellers evne til at undgå immungenkendelse, eller ved direkte genetisk manipulation af en patients egne immunceller til at genkende kræftcellerne. Sidstnævnte procedure er virkelig en helt ny type behandling, som basalt ikke tilhører kemoterapi - men genterapi. Særligt interessante er kliniske forsøg, som blev fremlagt i februar 2014 fra amerikanske forskere, hvor 16 patienter med fremskreden og resistent leukæmi blev behandlet med deres egne omprogrammerede immunceller. Forskerne kunne vise at 14 ud af de 16 patienter responderede så godt på behandlingen, at de kunne overføres til fortsat behandling med knoglemarvstransplantation, som er standard. Det er et fantastisk resultat.
Stoffer, som booster immungenkendelse af kræftceller, har allerede gjort deres indtog i den kliniske kræftbehandling. En markant begivenhed, af flere årsager, skete i 2011 med godkendelse af stoffet ipilimumab (salgsnavn Yervoy, Bristol-Myers Squibb) til behandling af aggressiv modermærkekræft også kaldet melanom. Et nyligt publiceret studie viste, at op mod 25% af patienterne, som responderede på behandling med ipilimumab, var i live efter 3 år, og at op mod 10-15% af disse med stor sandsynlighed er kurerede for deres sygdom. Det kan måske virke som lave tal, særligt fordi kun ca. 10-15% af patienter overhovedet responderer på behandlingen, men det er faktisk en markant forbedring i forhold til tidligere behandlinger.
Dette illustrerer meget godt, hvor vanskelig situationen er for behandling af mange typer af fremskredne kræftsygdomme. Ipilimumab er altså godkendt til behandling i mange lande herunder Danmark, men f.eks. så endte de engelske myndigheder med ikke at tage behandlingen i brug. Grunden var simpel: prisen set i forhold til antallet af patienter, som faktisk havde gavn af behandlingen. Omkostningerne til en behandling med ipilimumab (4 infusioner) ligger på mere end 500.000 kr. Flere stoffer i denne klasse vil afgjort følge ipilimumab i de kommende år.
Opsamling
Hvor står vi så nu? Jeg håber, at læseren har fået den fornemmelse, at den medicinske kræftbehandling til stadighed bliver mere sofistikeret. Vi er gået fra den cytotoksiske kemoterapi, som virker ved at sætte en stopper for kræftcellernes hovedmotor, til den målrettede kemoterapi, som er rettet mod finmekanikken. Resistens er en udfordring inden for begge paradigmer. Der er desuden en kraftigt accelererende tendens til, at behandlingerne skræddersyes til den enkelte patient ud fra den unikke genetiske profil af patientens kræftsygdom. I horisonten venter helt nye typer behandlinger, som måske har potentialet til at undertrykke kræftsygdomme i endnu længere tid, og forhåbentlig venter flere eksempler, hvor en dødelig kræftsygdom kan gøres til en kronisk tilstand, som man kan leve med. Ligesom det er tilfældet med CML. Er dette gode nyheder? Selvfølgelig! Enhver forbedring i kræftramtes overlevelseschancer har implikationer for en hel familie, ikke bare for patienten selv. Den ekstra tid, hvor en kræftpatient har et relativt godt helbred, er i sagens natur - netop - uvurderlig.
Hvis noget er unikt og uvurderligt, men det alligevel skal prissættes, så vil prisen være det, markedet kan bære. Hvis der ikke er konkurrence fra andre firmaer, så vil prisen afgøres af, hvor meget myndigheder og forsikringsselskaber har mulighed for at betale. Borgerne/forsikringskunderne kommer selvfølgelig med nogle klare forventninger om, at hvis en given behandling er mulig, så kan den også tilbydes. Gleevec gik ind på det amerikanske marked i 2001 til en pris på $30.000 (ca. 160.000 DKK) om året. Nu koster den samme behandling næsten $100.000 (ca. 550.000 DKK). Produktet er uvurderligt, der er ingen konkurrence, og markedet kan bære det. Hvis en patient skulle blive resistent over for Gleevec, så findes der som sagt nu nyere stoffer, der kan anvendes som 2. linie behandling, og de er endnu dyrere end Gleevec. Faktisk virker de også endnu bedre end Gleevec. Kan man forestille sig, at de rykkes frem til anvendelse i 1. linie behandling? I så fald, så vil omkostningerne til behandling af CML fortsat være høje, idet det er svært at forsvare at give patienter et - i mangel af bedre udtryk - 2-rangs medikament.
Det er nok ikke helt naivt at forestille sig, at fremtidens kamp mod en række kræftsygdomme (som ikke kan kureres ved operative indgreb eller stråleterapi) vil blive en slags molekylær skak. Vores stadig bedre forståelse af sygdommen, dvs. i den unikke genetiske udgave, som kendetegner den enkelte patient, kan resultere i sekvenser af modtræk, når effektiviteten af den førliggende behandling ophører. Hvis vi har at gøre med en "smart cancer", så er selv de allernyeste målrettede behandlinger sjældent effektive i mere end 6-12 måneder. Måske vil vi om nogle år have effektive livsforlængende behandlinger ikke kun i 1. og i 2. Linie, men måske også i 3. og 4 eller endnu længere. Dette kan betyde, at rigtig mange forskellige stoffer kommer til at udgøre isolerede monopoler, idet en given behandling på et eller andet tidspunkt næsten med sikkerhed vil involvere alle stofferne, og de er alle livsnødvendige for patienten. Sådanne behandlingsforløb vil understøtte høje priser. Man kan mene, at der burde være en klar sammenhæng mellem en behandlings effektivitet og dens pris, men som tidligere nævnt, så er dette langt fra tilfældet. Der findes eksempler på, at en prissætning på et nyt stof simpelthen har fået læger til at sige fra, f.eks. på Memorial Sloan Kettering Cancer Center i New York, som i 2012 besluttede ikke at bruge et nyt middel til behandling af endetarmskræft, til trods for at midlet blev godkendt til klinisk behandling på resultater, der viste en forbedret overlevelse i forhold til standardbehandlingen. Forbedringen var dog kun på i gennemsnit 1.2 måneder, og på trods af denne umiddelbart marginale forbedring, så var det nye produkt prissat til det dobbelte af den almindelige behandling.
Det virker selvfølgelig barokt, men igen, hvor mange penge er en ekstra måned sammen med sin familie værd? Lægernes boykot af behandlingen fik efterfølgende medicinalfirmaet til at give 50% rabat på behandlingen. En sådan situation kan ikke let opstå i Danmark, da det ikke er op til det enkelte hospital, hvilke behandlinger de vil tilbyde, men den er bestemt værd at have i tankerne, idet den ganske godt viser, hvilken rolle medicinalindustrien spiller. Vi kan forvente, at den - ligesom alle andre firmaer med produkter, som skal sælges - tester grænsen for, hvad markedet kan bære.
Det er selvfølgelig svært at spå om, hvad der præcist kommer til at ske, men der er mange indikationer på, at disse omkostninger virkelig kan løbe løbsk. WHO rapporterede tidligere i år, at man forventer en stigning i antallet af årlige kræfttilfælde fra ca. 12 millioner på verdensplan (2012) til næsten 22 millioner i 2035. Hovedfaktorerne, der ligger til grund for denne forventede fordobling, er den stigende alder af befolkningen samt en lang række livsstilsfaktorer. WHO konkluderer, at man simpelthen er nødt til at finde måder at nedbringe antallet af patienter ved forebyggelse, idet man ikke vil kunne betale omkostningerne. Det er utvivlsomt en god ide fortsat at investere i forebyggelse, men spørgsmålet er, om det er ret realistisk, at man kan ændre dramatisk på udviklingen. Vil man kunne betale omkostningerne? Jeg mener, at det direkte svar må være ja, idet behandlingen aldrig vil komme til at koste mere, end myndigheder og forsikringsselskaber har råd til at betale, men vi vil komme til at se, hvor denne grænse rent faktisk ligger. Det er sandsynligt, at dette vil betyde, at andre dele af sundhedsområdet, hvor det måske ikke er liv og død der er på spil, vil miste ressourcer.
Forskningen buldrer fremad og vinderne er heldigvis kræftpatienterne. For et sundhedssystem, hvor de økonomiske ender skal kunne nå hinanden, så er der dog grund til at holde ekstra godt øje med dette område. Kliniske gennembrud, måske fra områder nævnt ovenfor, kan resultere i behandlingsscenarier, som vi endnu ikke har oplevet. Hvad vil f.eks. en ny medicinsk behandling, som kan kurere 50 procent eller flere patienter i en af de store kræftformer, koste? Ingen ved det.
Methotrexate og Paclitaxel
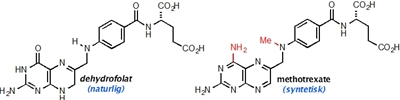
Nu er det tid til lidt mere detalje, så lad os komme tilbage til Dr. Farber og hans forsøg. Det stof, han testede for første gang i 1948, hedder aminopterin og er nært beslægtet med et andet stof, methotrexate (Figur 2b), som stadig anvendes i diverse behandlinger. Disse stoffer er såkaldte analoger (dvs. nært beslægtede stoffer) af et naturligt vitamin, som hedder folinsyre - et stof som mange af os kender, idet gravide kvinder helst skal indtage et ekstra tilskud af stoffet i nogle perioder af graviditeten.
Folinsyre har mange roller i kroppen, men specielt indgår det i de stofskifteprocesser, som er involveret i syntesen af DNA (Figur 2a). Denne specifikke funktion af folinsyre havde Sidney Farber dog ingen viden om, men han vidste dog, at stoffet kunne få kræftceller (såvel som almindelige celler) til at dele sig hurtigere. Retrospektivt, så giver disse observationer selvfølgelig god mening, idet det er nødvendigt for cellerne at kopiere alt deres DNA, inden de kan dele sig. Selvom han ikke kendte noget til stoffets virkningsmekanisme, så antog han, at hvis man foretog små ændringer i molekylets struktur (Figur 2b), så ville man muligvis kunne danne et stof, som ikke længere ville kunne omsættes (og dermed stimulere celledeling), men som stadig ville kunne binde til de enzymer, som normalt ville omsætte folinsyre.
Sagt på en anden måde, så håbede han på, at man kunne finde et molekyle, som kunne blokere den normale cellulære proces, som omsætter folinsyre, og dermed opnå, at cellerne ville stoppe med at dele sig eller ligefrem dø. At han havde ret, har jeg selvfølgelig allerede afsløret, og vi ved nu, at aminopterin/methotrexate blokerer aktiviteten af et enzym, som kaldes dihydrofolat-reductase (DHFR), og som er afgørende for omsætningen af stoffet dihydrofolat til et andet stof kaldet tetrahydrofolat (Figur 2a,b). Dette stof er direkte involveret i fremstillelsen af DNA-byggesten, og som navnene antyder, så er begge stoffer selvfølgelig fremstillet fra folat/folinsyre. Meget små ændringer i et molekyles struktur kan altså betyde dramatiske forskelle i dets effekt på de proteiner, som indgår i alle vores celler.
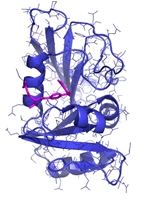
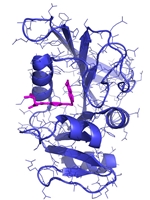
Hvis man kigger på det fra en molekylær vinkel, så er det faktisk temmelig svært at se, at sådanne små strukturelle ændringer skulle betyde noget som helst. Ved brug af røntgen krystallografi kan vi direkte observere begge typer molekyler, altså det naturlige vitamin eller inhibitoren, bundet til enzymet dihydrofolat reductase (DHFR, Figur 2c), og strukturerne ser jo unægteligt temmelig ens ud, men der er altså en verden til forskel. Idet aminopterin/methotrexate forhindrer det naturlige dihydrofolat i at få adgang til enzymet, så falder mængden af tetrahydrofolat i cellerne, som nu ikke er i stand til at fremstille de nødvendige byggesten til syntesen af DNA. Det er faktisk en meget simpel virkningsmekanisme. Methotrexate bliver stadig brugt i kræftbehandlingen, men kun i kombinationer med andre typer af kemoterapi. Desuden er stoffet blevet godkendt til behandling af blandt andet gigt og psoriasis. Begge lidelser skyldes et over-aktiveret immunsystem, og ved således at dæmpe væksten af immuncellerne, så kan methotrexate altså afhjælpe begge disse lidelser, som påvirker mange millioner mennesker verden over.
Figur 2a: Folinsyre og tetrahydrofolat
<img align="left" src="@nyimg=16628@" />
Folinsyre kan i kroppen omsættes til stoffet tetrahydrofolat, som direkte er involveret i syntesen af DNA.
Figur 2b: Dehydrofolat og methotrexate
<img align="left" src="@nyimg=16629@" />
Kemiske strukturer af dehydrofolat samt methotrexate
Figur 2c: Sådan binder DHFR
<img align="left" src="@nyimg=16630@" /><img align="left" src="@nyimg=16631@" />
Strukturer, der viser hvordan hhv. dehydrofolat og methotrexate binder enzymet DHFR. Dehydrofolat kan omsættes af enzymet, mens methotrexate ikke kan.
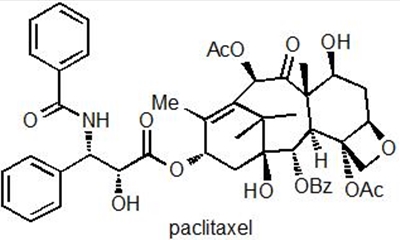
Fra en kemikers synsvinkel, så er methotrexate et relativt simpelt molekyle. Det består af få ringsystemer, som sidder sammen med simple bindinger og har en simpel 3-dimensionel struktur. En helt anden slags molekyle er stoffet paclitaxel, som kan ses i Figur 3a. Her udgøres strukturen af en lang række sammensatte ringssystemer af meget forskellig størrelse og betydelig 3-dimensionel kompleksitet. Ligesom methotrexate, så er paclitaxel også et molekyle, som hæmmer kræftcellers vækst, men stoffets virkningsmekanisme er meget anderledes. Når en celle skal dele sig, så skal DNA'et som sagt kopieres, så hver dattercelle kan få en komplet kopi.
Rent strukturelt, så indgår DNA'et i komplekser med en lang række proteiner, og disse komplekser kaldes for kromosomer. Antallet af kromosomer varierer i forskellige organismer, og specifikt så udgøres menneskets arveanlæg af i alt 46 kromosomer (23 par).
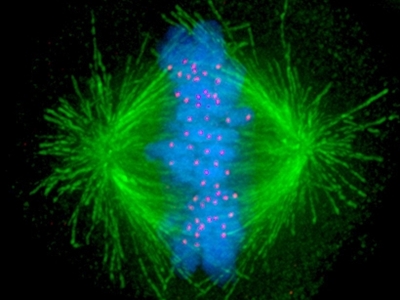
Vores celler har en lang række kontrolforanstaltninger, som er med til at sikre, at kromosomer ikke bliver placeret forkert under celledeling, således at dattercellerne modtager et forkert antal. I denne henseende spiller strukturer, som kaldes mikrotubuli, en helt særlig rolle, idet de direkte holder fast i kromosomerne, og når cellen skal dele sig, så trækker de kromosomerne til hver sin side (kaldet pol) i det, der efterfølgende bliver til de to datterceller. Dette kan ses i Figur 3b, hvor mikrotubuli er farvet grønt og kromosomerne er blå.
Alle de røde prikker er faktisk de præcise steder, hvor mikrotubuli har fat i kromosomerne. Der burde være 92 (46x2) men det er ikke alle, som er synlige på billedet. Det ses klart, at de grønne mikrotubuli stråler ud fra hver sin pol i modsatte ender af cellen. Selvom billedet i Figur 3b per definition er statisk og viser en celle, lige inden kromosomerne trækkes fra hinanden, så kræver succesfuld celledeling faktisk, at mikrotubuli-strukturerne er meget dynamiske. Hvis man kigger i større detalje, består de af lange kæder af repeterende enheder, som kaldes alfa og beta (de to enheder er vist i gul og orange i figur 3c), og afhængig af den specifikke sammenhæng, så vokser eller krymper de konstant.
Figur 3a: Kemisk struktur af paclitaxel
<img align="left" src="@nyimg=16632@" />
Figur 3b: Fluorescens-mikroskopi billede af en kræftcelle
<img align="left" src="@nyimg=16633@" />
Fluorescens-mikroskopi billede af en kræftcelle, som er ved at dele sig (kaldet anafase). De komponenter i cellen, som er farvet er: kromosomer (blå), mikrotubuli (grøn), kinetochorer (rød), som er strukturer hvor mikrotubuli binder til kromosomerne.
Figur 3c: Mikrotubuli med paclitaxel
<img align="left" src="@nyimg=16634@" />
Strukturer af den mindste repeterende enhed, som udgør mikrotubuli med paclitaxel (pink) bundet.
Paclitaxel, det komplekse molekyle, vi nævnte ovenfor, ændrer radikalt på den sag. Ved at binde til den ene enhed (paclitaxel kan ses i pink i figur 3c), så stabiliserer paclitaxel cellens mikrotubuli, og dette viser sig at være meget giftigt for celler, som deler sig hurtigt. Enten kan cellen slet ikke dele sig, eller også sker der fejlplaceringer af kromosomerne, som efterfølgende bliver opdaget af endnu et sæt kontrolmekanismer, der direkte forårsager, at dattercellerne slår sig selv ihjel i en proces, man kalder for apoptose.
Imatinib/Gleevec
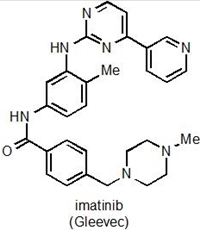
4.a Kemisk struktur i imainib
<img align="left" src="@nyimg=16635@" />
4.b Genetisk skade som forårsager CML
<img align="left" src="@nyimg=16636@" />
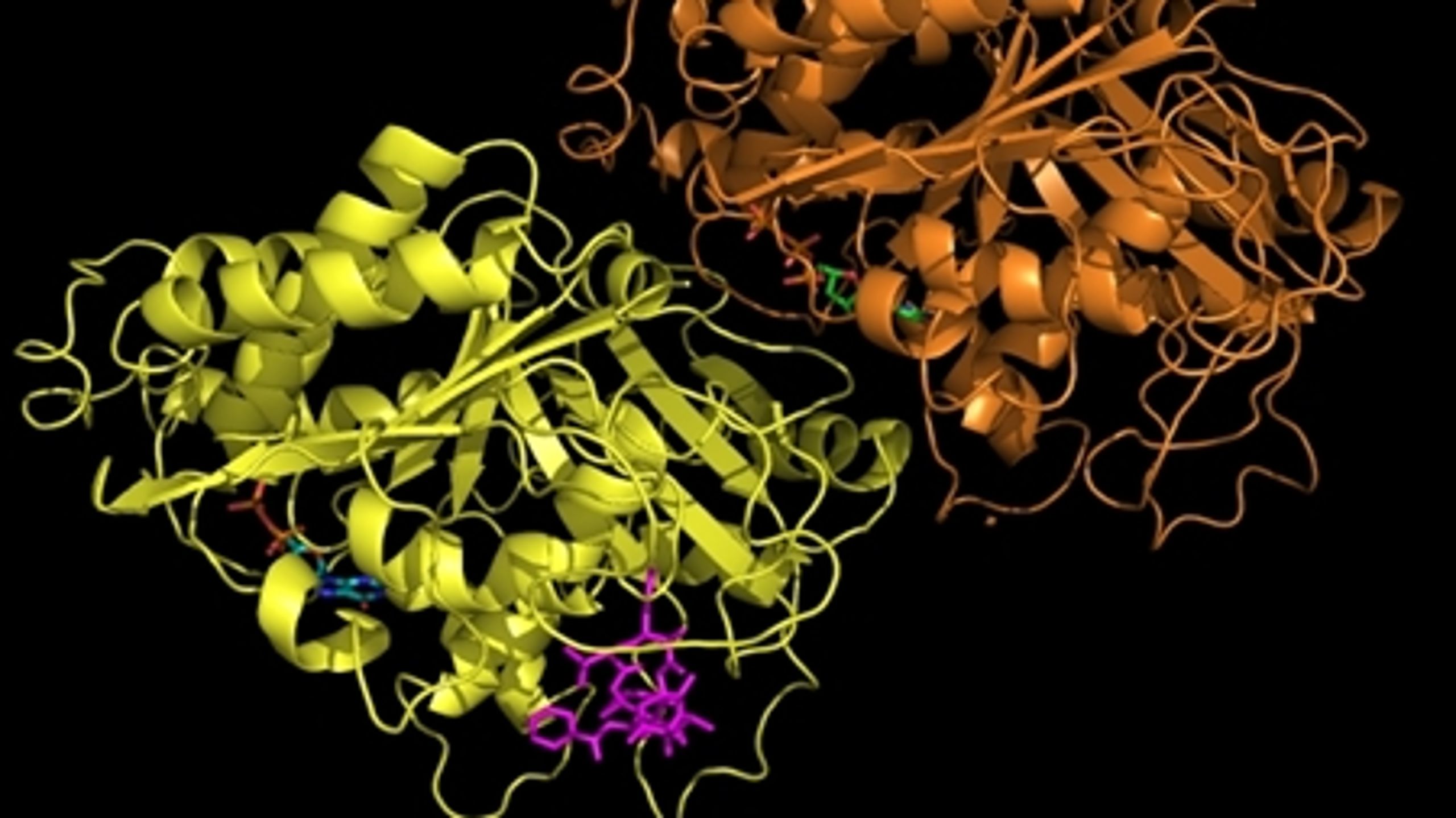
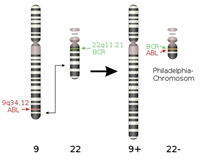
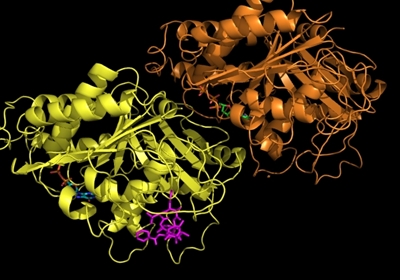
Figur 4. a: Kemisk struktur af imatinib. b: Tegning der viser den type genetisk skade, som forårsager leukæmi-formen CML. Dannelsen af philadelphia kromosomet ved ombytning af dele af kromosom 9 og 22, genererer fusionsproteinet BCR-Abl.
Imatinib (den kemiske struktur kan ses i Figur 4a) virker ved at hæmme et protein kaldet BCR-Abl, som er et såkaldt fusionsprotein, idet det dannes som følge af, at dele af to forskellige kromosomer simpelthen skifter plads, og dermed fusioneres to proteiner BCR og Abl, som ellers intet har med hinanden og gøre (Figur 4b). Et af de resulterende nye kromosomer er markant mindre end udgangspunktet, og dette lille kromosom kaldes for Philadelphia kromosomet. I forhold til den type genetiske ændringer, som man kalder for punktmutationer (ændringer af blot én DNA byggesten til en anden), så er der her tale om en meget dramatisk ændring i cellernes arveanlæg.
Abl proteinet er et såkaldt kinase enzym, som er et meddelerprotein i cellerne. Det udgør en slags kontakt i mellem de signalstoffer, som receptorer på cellens overflade konstant modtager fra deres omgivelser, og de processer, som kan lede frem til celledeling. Denne slags kontakter er normalt under skarp kontrol i vores celler. Når Abl fusioneres med BCR, kommer proteinet så at sige ud af kontrol, hvilket resulterer i konstante signaler om, at cellen skal begynde at dele sig, og således opstår kræftsygdommen.
Det virker måske nu åbenlyst, at et molekyle, som specifikt blokerer aktiviteten af BCR-Abl, kunne have en dramatisk effekt på sygdommen CML, men det var ikke en erkendelse, som let fandt vej til de første kliniske forsøg. At det overhovedet skete, kan tilskrives en utrættelig indsats af en amerikansk professor ved navn Brian Druker, som pressede en af de store medicinalvirksomheder, som i dag hedder Novartis, til at foretage de nødvendige kliniske tests med et specifikt molekyle, nemlig imatinib (Gleevec), som han havde fremstillet. Det er på mange måder en fantastisk historie.









