Forsigtig optimisme om medicinsk udstyr
OPSTRAMNING: De første reaktioner på EU’s vidtgående nye regelsæt for medicinsk udstyr er forholdsvis positive, selv om industrien ømmer sig over strammere krav.

Rikke Albrechtsen
EU-redaktørBRUXELLES: I de uger, der nu er gået, siden EU’s lovgivere blev enige om et sæt nye regler, der strammer gevaldigt op på tilsynskravene til medicinsk udstyr, har interessenterne læst i kaffegrums, udfrittet alle de tre EU-institutioner, der har deltaget i forhandlingerne om de nye regler, og generelt gjort deres for at blive klogere på, præcis hvad den nye aftale indebærer for patienter, læger og industri.
Detaljerne i de mange hundrede sider lovtekst i de to forordninger, der skaber ny, strammere kontrol med alt fra hofteimplantater til graviditetstests, er endnu ikke offentliggjort. Det bliver de ifølge det hollandske EU-formandskab tidligst med udgangen af juni, når den juridiske og tekniske gennemgang af aftalen er på plads.
Men i overskriftsform kan den europæiske paraplyorganisation for patientforeninger, European Patient’s Forum (EPF), støtte de nye regler, der blandt andet skaber større producentansvar, øger krav til produktgodkendelse, skaber et nyt identificeringssystem til sporing af implantater og øger kontrollen med produkter, der allerede er på markedet.
”Vi kan kun byde denne aftale velkommen, eftersom den tydeligvis baner vejen for et sikrere og mere robust system for medicinsk udstyr. Men for fuldt at kunne vurdere indflydelsen på patientsikkerhed og på kvaliteten i sundhedsplejen har vi brug for flere detaljer,” siger generalsekretær Nicola Bedlington.
Patientinddragelse og engangsudstyr
Organisationen er stadig nervøs for, hvordan forslaget er endt, når det kommer til patientinddragelse, hvor den har presset på, for at patienter kan komme til at sidde med i ekspertgrupper, hvor de kan give deres besyv med om ting som patientsikkerhed, overvågning, klinisk efterprøvning og patientinformation.
Derudover venter EPF stadig på mere afklaring over et særligt følsomt emne i forhandlingerne, der handler om genbrug af engangsudstyr.
”Vi håber, at der snart kommer flere detaljer, så vi kan få afværget tvivlen i patientkredse,” lyder det fra organisationen.
Strid til det sidste
Det har været meget sparsomt med oplysninger om netop den del af aftalen, fordi der var strid til det sidste om netop det emne. Resultatet er ifølge kilder i Bruxelles blevet, at det bliver tilladt for for eksempel sygehuse at genbruge engangsudstyr, hvis det enkelte medlemsland tillader det.
EU-Kommissionen er blevet bedt af de to lovgivere Ministerrådet og EU-Parlamentet om at fremkomme med en negativliste over udstyr, som ikke skal kunne genanvendes, hvilket Kommissionen er voldsomt utilfreds med, da den vurderer, at det er en helt umulig opgave.
Det dækker de nye regler:
- Strengere kontrol med nationale bemyndigede myndigheder
- Flere kontrolbesøg hos producenter, også efter produkter er markedsført
- Større producentansvar – også for blandt andet at registrere klager
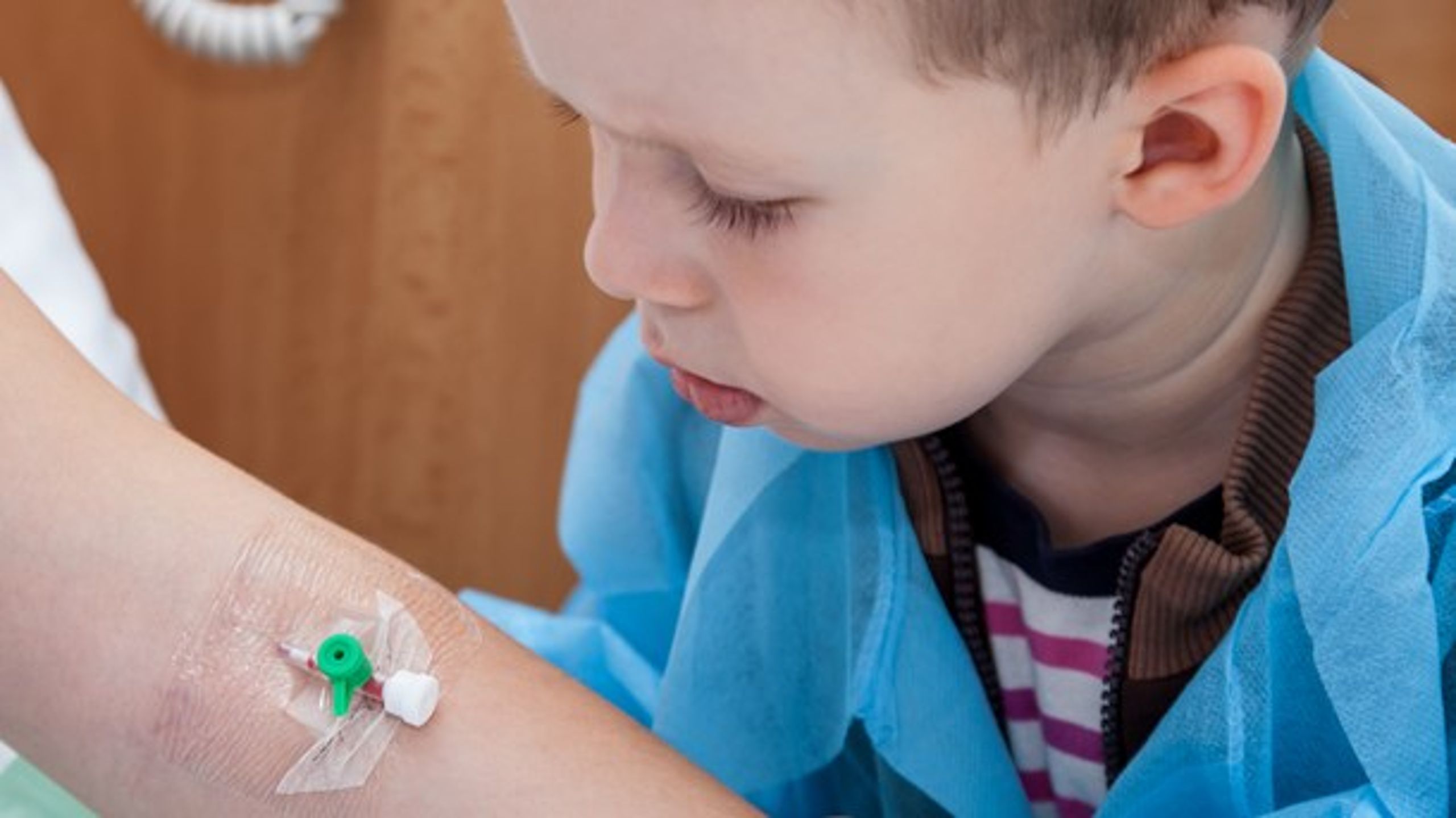
- Øget sikkerhedsprocedurer for særlige højrisikoprodukter som for eksempel implantater
- Skabelse af et ”implantat-kort” til patienter, der gør det muligt at holde styr på, præcis hvilket implantat der er blevet indopereret
- Større krav til klinisk efterprøvelse af produktsikkerhed, særligt for højrisikoprodukter
- Forbedring af produktdatabasen EURAMED
- Inddragelse af kosmetiske produkter som farvede kontaktlinser og såkaldte fillers brugt i rynkebehandlinger
- Pligt til at informere og rådgive om mulige konsekvenser ved DNA-tests